Dank aktueller Zulassungsänderungen können Mütter unter einer MS-Therapie mit OCREVUS
(Ocrelizumab) direkt nach der Geburt mit dem Stillen beginnen. Die Behandlung kann bereits
wenige Tage nach der Geburt begonnen werden.1,2 Damit ist OCREVUS die erste und einzige
hochwirksame Therapie, die uneingeschränkt für die Stillzeit zugelassen ist.
Auch die Notwendigkeit zur Empfängnisverhütung nach der letzten OCREVUS-Dosis verkürzt
sich von 12 auf 4 Monate, sodass eine Schwangerschaft innerhalb des regulären
Applikationsintervalls möglich ist.1,2 Die Zulassungsänderungen basieren auf der
umfassendsten Datenbasis aller Anti-CD20-Therapien mit über 4.000 dokumentierten
Schwangerschaften sowie 2 Phase-IV-Studien.3–5
Grenzach-Wyhlen, 08.05.2025
- Die Notwendigkeit zur Empfängnisverhütung nach der letzten OCREVUS®-Dosis verkürzt sich von 12 auf 4 Monate.1,2
- Ab sofort können Mütter unter einer OCREVUS-Therapie ihr Kind ohne Einschränkungen direkt nach der Geburt stillen.1,2
- Die Vereinbarkeit von Familienplanung mit einer hocheffektiven Therapie eröffnet neue Perspektiven für Frauen mit MS.
Vernachlässigbare Übertragung von OCREVUS in die Muttermilch
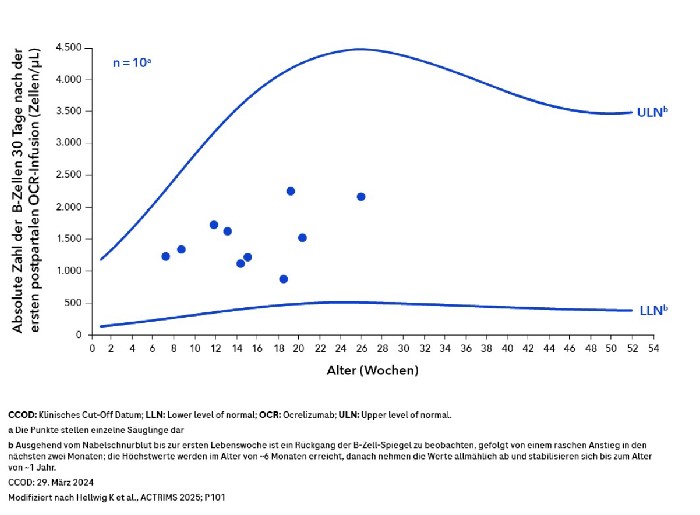
Die Phase-IV-Studie SOPRANINO evaluierte die B-Zell-Spiegel von Säuglingen und eine mögliche Übertragung von OCREVUS in die Muttermilch von stillenden Frauen.5 Die Daten zeigten eine vernachlässigbare Übertragung des Anti-CD20-Antikörpers in die Muttermilch. Auch im Serum der gestillten Säuglinge ließen sich keine messbaren OCREVUS-Konzentrationen nachweisen und die B-Zell-Werte der Säuglinge lagen im Normbereich (siehe Abb.).5 Das allgemeine Gesundheitsbild der Säuglinge entsprach der üblichen Entwicklung im 1. Lebensjahr.5 Die SOPRANINO-Studie ist die erste und einzige Studie, die stillende Frauen
unter einer hocheffektiven verlaufsmodifizierenden Therapie (Disease Modifiying Therapy, DMT) bei MS untersucht hat.
Normale B-Zell-Spiegel bei Säuglingen nach der Geburt
In der Phase-IV-Studie MINORE wurde die plazentare Übertragung und die B-Zell-Spiegel bei Säuglingen nach möglicher OCREVUS-Exposition während der Schwangerschaft untersucht.3 Die Ergebnisse zeigten, dass eine potenzielle Exposition gegenüber OCREVUS während der Schwangerschaft die B-Zell-Konzentration beim Säugling nicht veränderte. OCREVUS war
sowohl im Nabelschnur-Serum bei der Geburt als auch im Säuglings-Serum in der 6. Lebenswoche größtenteils nicht nachweisbar, was auf einen minimalen Plazentatransfer und eine geringe in-utero-Exposition hindeutet.3 Die beobachteten unerwünschten Ereignisse lieferten keine neuen Sicherheitssignale für Schwangerschaft und Geburt bzw. die Zeit nach
der Entbindung und das Säuglingsalter.3
Umfangreiche Real-World-Daten bestätigen die Sicherheit
Die Analyse der umfangreichen Real-World-Daten bestätigte die Ergebnisse der klinischen Studien und zeigte, dass eine OCREVUS-Exposition das Risiko für unerwünschte Ereignisse während der Schwangerschaft oder beim Säugling im Vergleich zur Gesamtbevölkerung nicht erhöht.4 Auch die Schwangerschaftsdauer war überwiegend regulär, wobei die Ergebnisse zwischen exponierten und nicht exponierten Schwangerschaften vergleichbar waren.4 Die Zulassungsänderungen für den Einsatz von OCREVUS bis kurz vor der Schwangerschafta und während der Stillzeit eröffnen wichtige Perspektiven für Frauen mit MS: Sie müssen sich nun nicht mehr zwischen einer effektiven Krankheitskontrolle und der Gesundheit ihres (ungeborenen) Kindes entscheiden.
a Frauen im gebärfähigen Alter müssen während der Behandlung mit OCREVUS und für 4 Monate nach der letzten
verabreichten Dosis von OCREVUS eine Empfängnisverhütung anwenden.1,2 (Stand der Information: Februar 2025)
Referenzen
[1] Fachinformation Ocrevus® i. v. 300 mg; Stand: Februar 2025
[2] Fachinformation Ocrevus® s. c. 920 mg; Stand: Februar 2025
[3] Hellwig K et al., ACTRIMS 2025; Poster #P106 + Suppl.
[4] Dobson R et al., ECTRIMS 2024; Poster #P085
[5] Hellwig K et al., ACTRIMS 2025; Poster #P101 + Suppl.
[6] Hauser SL et al., N Engl J Med 2017; 376: 221–34
[7] Montalban X et al., N Engl J Med 2017; 376: 209–20
Alle erwähnten Markennamen sind gesetzlich geschützt.
Über OCREVUS®
OCREVUS (Ocrelizumab) ist ein humanisierter monoklonaler Antikörper, der selektiv gegen CD20-positive B-Zellen gerichtet ist. CD20-positive B-Zellen sind spezielle Immunzellen, die vermutlich wesentlich zur Schädigung der Myelinscheide Isolationsstruktur von Nervenzellfortsätzen), der Axone (Nervenzellfortsätze) und der daraus resultierenden Behinderung bei Patienten mit MS beitragen. Wie präklinische Studien gezeigt haben, bindet OCREVUS an CD20-Oberflächenproteine, die auf bestimmten B-Zellen exprimiert werden, nicht jedoch auf Stammzellen oder Plasmazellen. Deshalb bleiben wichtige Funktionen des Immunsystems erhalten.
Das klinische Entwicklungsprogramm der Phase III für OCREVUS (ORCHESTRA) umfasste drei Studien: OPERA I, OPERA II und ORATORIO. OPERA I und OPERA II waren identisch aufgebaute, randomisierte, doppelblinde, multizentrische Doppelstudien, die die Wirksamkeit und Sicherheit von OCREVUS (600 mg, verabreicht durch intravenöse Infusion alle 24 Wochen) im Vergleich zu Interferon beta-1a s.c. (44 μg durch subkutane Injektion dreimal pro Woche) bei 1.656 Personen mit schubförmiger MS bewertet haben.6 ORATORIO war eine randomisierte, doppelblinde, multizentrische Phase-III-Studie, die die Wirksamkeit und Sicherheit von OCREVUS (600 mg intravenöse Infusion alle 24 Wochen aufgeteilt in zwei 300 mg Infusionen mit zwei Wochen Abstand) im Vergleich zu Placebo bei 732 Personen mit primär progredienter MS (PPMS) untersucht hat.7
OCREVUS wird biotechnologisch in den USA hergestellt – mit der Abfüllung des Medikaments für den globalen Markt erfolgt ein wesentlicher Produktionsschritt am Roche Standort Mannheim. OCREVUS ist aktuell in 92 Ländern in Nordamerika, Südamerika, Osteuropa, im Nahen Osten sowie in Australien, der Schweiz und seit Januar 2018 in der EU zugelassen.
Roche – Informationen zum Unternehmen
Ihre Ansprechpartner:innen
Für Anfragen zum Unternehmen:
Faten Gaber
Head of Communications & Public Affairs
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
grenzach.communications@roche.com
Tel. 07624 14-4000
Für Anfragen zu Produkten:
Ferdinand Tessin
Teamlead Product Communications
Roche Pharma AG
Emil-Barell-Straße 1
79639 Grenzach-Wyhlen
ferdinand.tessin.ft1@roche.com
Tel. 07624 14-4050